- Стандартна ентальпія освіти (стандартна теплота утворення)
- Температурна залежність теплового ефекту (ентальпії) реакції
- Стандартна ентальпія згоряння
- Стандартна ентальпія розчинення
- Стандартна ентальпія нейтралізації
- література
Тепловий ефект хімічної реакції або зміна ентальпії системи внаслідок протікання хімічної реакції - віднесене до зміни хімічної змінної кількість теплоти, отримане системою, в якій пройшла хімічна реакція і продукти реакції взяли температуру реагентів.
Щоб тепловий ефект був величиною, яка тільки від характеру протікає хімічної реакції, слід дотримуватись таких умов:
- Реакція повинна протікати або при постійному обсязі Q v (Ізохоричний процес), або при постійному тиску Q p ( ізобарний процес ).
- У системі не відбувається ніякої роботи, крім можливої при P = const роботи розширення.
Якщо реакцію проводять в стандартних умовах при Т = 298 К і Р = 1атм, парниковий ефект називають стандартним тепловим ефектом реакції або стандартної ентальпії реакції Δ H rO. У термохіміі стандартний тепловий ефект реакції розраховують за допомогою стандартних ентальпій утворення.
Стандартна ентальпія освіти (стандартна теплота утворення)
Під стандартною теплотою освіти розуміють тепловий ефект реакції утворення одного моля речовини з простих речовин, його складових, що знаходяться в стійких стандартних станах . Позначається Δ H fO.
Наприклад, стандартна ентальпія утворення 1 моль метану з вуглецю і водню дорівнює тепловому ефекту реакції:
С (тв) + 2H2 (г) = CH4 (г) + 76 кДж / моль.
Ентальпія утворення простих речовин приймається рівною нулю, причому нульове значення ентальпії освіти відноситься до агрегатному стані, стійкого при T = 298 K. Наприклад, для йоду в кристалічному стані Δ H I2 (тв) 0 = 0 кДж / моль, а для рідкого йоду Δ H I2 (ж) 0 = 22 кДж / моль. Ентальпії утворення простих речовин при стандатних умовах є їх основними енергетичними характеристиками.
Тепловий ефект будь-якої реакції знаходиться як різниця між сумою теплот освіти всіх продуктів і сумою теплот утворення всіх реагентів в даній реакції (наслідок закону Гесса ):
Δ H реакцііO = ΣΔ H fO (продукти) - ΣΔ H fO (реагенти)
Термохімічні ефекти можна включати в хімічні реакції. Хімічні рівняння в яких зазначено кількість виділилася або поглиненої теплоти, називаються термохімічними рівняннями. Реакції, сопровождающіемя виділенням тепла в окружащію середу мають негативний тепловий ефект і називаються екзотермічні . Реакції, що супроводжуються поглинанням тепла мають позитивний тепловий ефект і називаються ендотермічними . Тепловий ефект зазвичай відноситься до одного молю прореагировавшего вихідної речовини, стехіометричний коефіцієнт якого максимальний.
Температурна залежність теплового ефекту (ентальпії) реакції
Щоб розрахувати температурну залежність ентальпії реакції, необхідно знати молярний теплоємності речовин, що беруть участь в реакції. Зміна ентальпії реакції при збільшенні температури від Т1 до Т2 розраховують за законом Кірхгофа (передбачається, що в даному інтервалі температур молярний теплоємності не залежить від температури і немає фазових перетворень ):
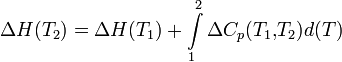
Якщо в даному інтервалі температур відбуваються фазові перетворення, то при розрахунку необхідно врахувати теплоти відповідних перетворень, а так само зміна температурної залежності теплоємності речовин, що зазнали такі перетворення:
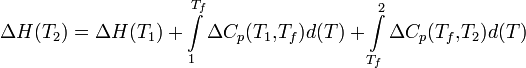
де ΔCp (T1, Tf) - зміна теплоємності в інтервалі температур від Т1 до температури фазового переходу; ΔCp (Tf, T2) - зміна теплоємності в інтервалі температур від температури фазового переходу до кінцевої температури, і Tf - температура фазового переходу.
Стандартна ентальпія згоряння
Стандартна ентальпія згоряння - Δ H горо, парниковий ефект реакції згоряння одного моля речовини в кисні до утворення оксидів вкрай окислення. Теплота згоряння негорючих речовин приймається рівною нулю.
Стандартна ентальпія розчинення
Стандартна ентальпія розчинення - Δ H раство, парниковий ефект процесу розчинення 1 моля речовини в нескінченно великій кількості розчинника. Cкладивается з теплоти руйнування кристалічної решітки і теплоти гідратації (Або теплоти сольватации для наведених розчинів), що виділяється в результаті взаємодії молекул розчинника з молекулами або іонами речовини, що розчиняється з утворенням сполук змінного складу - гідратів (сольватов). Руйнування кристалічної решітки, як правило, ендотермічний процес - Δ H реш> 0, а гідратація іонів - екзотермічний, Δ H гідр <0. У залежності від співвідношення значень Δ H реш та Δ H гідр ентальпія розчинення може мати як позитивний, так і негативний значення. Так розчинення кристалічного гідроксиду калію супроводжується виділенням тепла:
Δ H раствKOHо = Δ H решо + Δ H гідрК + про + Δ H гідрOH-о = -59КДж / моль
Під ентальпії гідратації - Δ H гідр, розуміється теплота, яка виділяється при переході 1 моля іонів з вакууму в розчин.
Стандартна ентальпія нейтралізації
Стандартна ентальпія нейтралізації - Δ H нейтроентальпія реакції взаємодії сильних кислот і основ з утворенням 1 благаючи води при стандартних умовах:
HCl + NaOH = NaCl + H2O H + + OH- = H2O, ΔHнейтр ° = -55,9 кДж / моль
Стандартна ентальпія нейтралізації для концентрованих розчинів сильних електролітів залежить від концентрації іонів, внаслідок измения значення ΔHгідратаціі ° іонів при розведенні.
література
- Кнорре Д.Г., Крилова Л.Ф., Музикантів В.С. «Фізична хімія», Москва, Вища школа, 1990.
- Еткінс П. «Фізична хімія», Москва, Мир, 1980
Wikimedia Foundation. 2010 року.

